Recherche
La mécanique du cœur : quand la valve mitrale déraille
« Boum-boum. Boum-boum ». Il est certainement l’organe le plus symbolique du corps humain : imprimé sur les cartes de Saint-Valentin, dessiné avec les doigts pour dire son amour à sa moitié derrière une vitre ou même, gravé au compas sur une table de classe, la réalité biologique du cœur est pourtant un peu moins tendre. À peine plus grand que la taille d’un poing fermé, il structure une anatomie extrêmement complexe. Parmi les nombreux éléments qui le compose : la valve mitrale qui impose un sens unique à la circulation sanguine et peut se trouver endommagée avec le temps et conduire à une dégradation progressive de la fonction cardiaque.
Daniel Grinberg est chirurgien cardiaque à l’hôpital Louis Pradel de Bron (HCL), et a récemment soutenu une thèse à l’INSA Lyon. En collaboration avec le laboratoires LGEF1, l’hôpital Mount Sinaï à New York, et son équipe hospitalière au CHU de Lyon, il travaille à l’élaboration d’un outil d’aide au chirurgien pour faciliter les chirurgies valvulaires mitrales et les rendre plus efficaces. Immersion au cœur de la machine.
La valve en bandoulière
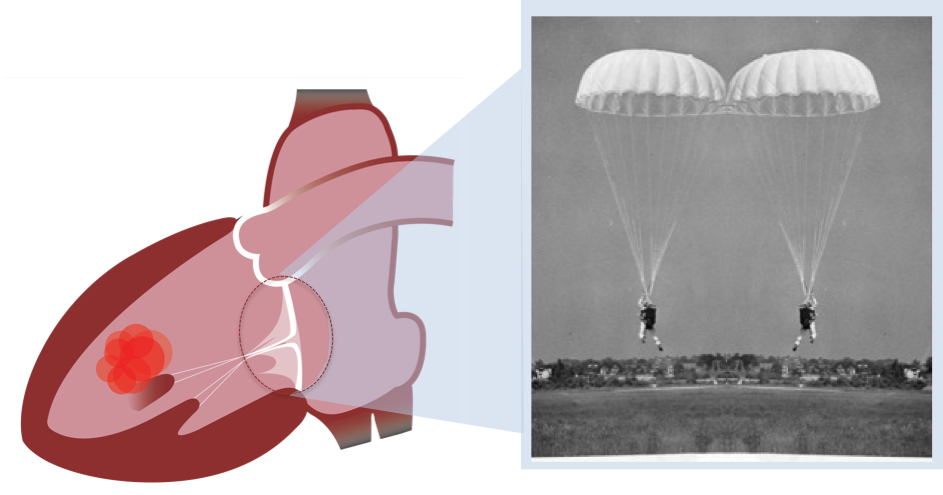
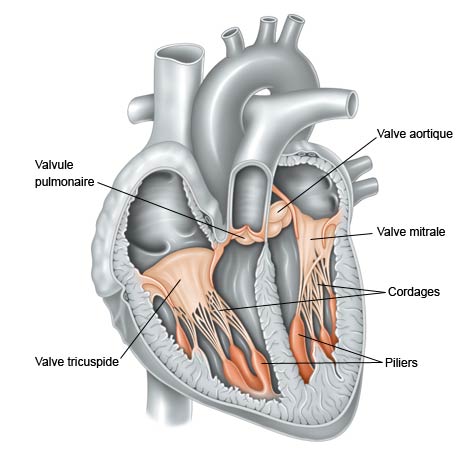
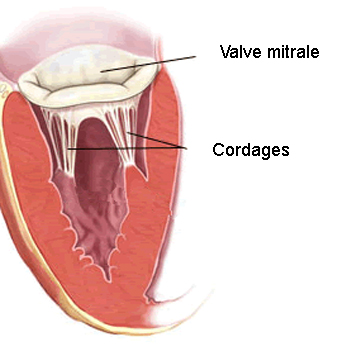
La valve mitrale est l’une des quatre valves séparant les cavités cardiaques qui composent le cœur. Comme un clapet, elle guide le sang, l’empêchant de revenir en arrière. « La valve mitrale se situe entre l’oreillette gauche et le ventricule gauche. Elle ressemble et fonctionne comme un double parachute : quand le cœur se contracte, le sang s’engouffre dans la voilure et les parachutes se gonflent jusqu’à se toucher. C’est ce contact qui forme le clapet antiretour et assure la circulation sanguine et ce, 2 milliards de fois au cours d’une vie humaine ! Dès lors qu’un élément des parachutes est abimé (la voilure, appelée ici « valvule » ou les fils tracteurs, appelés ici « cordages »), la valve mitrale n’assure plus son rôle et le cœur fatigue. Quand la mécanique ne fonctionne plus, il faut opérer, pour au mieux réparer la valve ou bien la remplacer par une prothèse », explique le docteur Grinberg, du service de chirurgie cardiaque adulte à l’hôpital Louis Pradel.
En France, près de 7000 chirurgies valvulaires mitrales sont réalisées chaque année. En cause de la dégénérescence de cet élément : le temps et l’âge. Plusieurs symptômes peuvent être associés à une mauvaise étanchéité de l’orifice mitral. « En matière d’insuffisance mitrale, il existe des traitements pour diminuer les symptômes, mais seule la chirurgie peut résoudre le fond du problème. Cette chirurgie est difficile car nous ne sommes pas en mesure d’évaluer en direct ce qu’il se passe physiquement dans le coeur pendant une opération. Par exemple, lorsque l’on effectue une réparation, on arrête le cœur : il est mou et vide de sang, alors lorsqu’il est remis en route, il se peut que cette réparation ne fonctionne pas aussi bien qu’elle devrait. Il n’existe pas de système à 100% fiable et certains patients reviennent nous voir des semaines, des mois ou des années après l’intervention pour une récidive de fuite. Nous avons donc cherché à développer des outils permettant d’évaluer les changements physiques survenants pendant la chirurgie, qui pourraient nous aider à éviter les récidives », ajoute le docteur.
La rencontre avec le laboratoire LGEF : « It’s a crush ! »
En 2015, lorsque le Dr. Daniel Grinberg et le Pf. Jean-François Obadia viennent frapper à la porte des laboratoires de l’INSA Lyon, ils travaillent déjà à remplacer les cordages rompus par des cordages artificiels en Gore Tex, sans même arrêter le cœur grâce au dispositif NeoChord DS1000®️. « C’est entre deux chirurgies et autour de quelques sandwichs que nous avons fait connaissance avec Pierre-Jean Cottinet, enseignant-chercheur à l’INSA Lyon et au LGEF, qui est par la suite devenu mon ami et mon directeur de thèse. Nous avons amené la première problématique : comment mesurer la tension qui s’exerce sur ces cordages artificiels pendant l’opération ? Cette question n’a été que la première d’une longue série », poursuit Daniel.
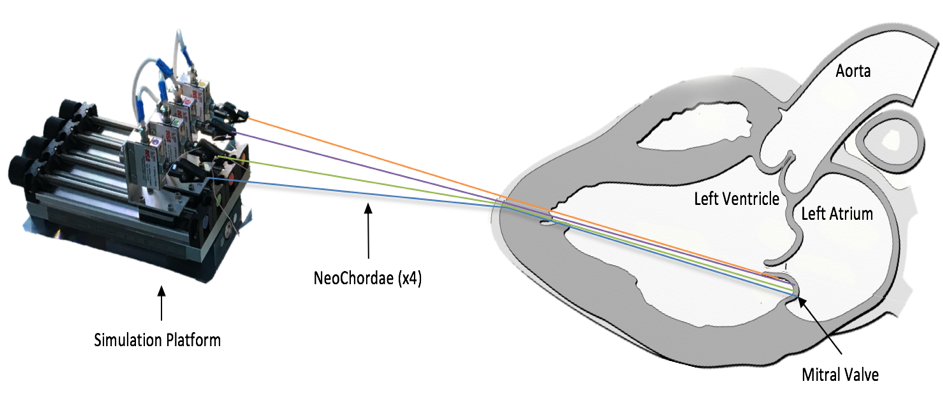
De fil en aiguille, les médecins et les chercheurs de l’INSA Lyon parviennent à développer un banc d’essai : c’est la première fois qu’il est possible de mesurer chez l’homme, à cœur battant et pendant une opération chirurgicale, la tension exercée sur les cordages mitraux. Le banc d’essai développé, désormais breveté2, a fait l’objet de différentes publications scientifiques et salué par les experts du domaine. Mais les chercheurs et médecins ne s’arrêtent pas là. « Les données récoltées par notre banc d’essai étaient totalement inédites et nous ont permis de mieux comprendre les maladies mitrales et les conséquences de la chirurgie. Mais après ces observations faites, il s’agissait de les comprendre. Nous avons débuté une collaboration avec des laboratoires spécialisés en imagerie médicale et en simulation numérique dont le laboratoire CREATIS3, pour créer et optimiser des modèles de « cœur numérique » et ainsi, essayer de comprendre les facteurs influençant la tension des cordages. Nous sommes encore en train de travailler sur le phénomène à travers un projet ANR intitulé ‘SIMR’. »
Le cœur à l’ouvrage
Parmi les autres paramètres capables d’influencer la qualité de l’étanchéité de la valve mitrale, il y a la coaptation, qui correspond à la force de contact entre les deux parachutes composant la valve. « La coaptation est la force que ces deux valvules ont à se fermer l’une contre l’autre et cette force conditionne l’étanchéité de la valve. C’est le sujet du second outil que nous avons développé et breveté pendant mon travail de thèse au LGEF. Nous voulons que cet outil puisse d’une part nous aider à comprendre les maladies et les conséquences de la chirurgie mitrale, et d’autre part, en faire un appareil qui permette d’assister le chirurgien pendant son intervention », poursuit-il.

Dans le cadre de sa thèse, Daniel Grinberg s’est envolé pour New York, à l’hôpital du Mont Sinaï. « Au sein de cet hôpital, que l’on peut considérer comme le ‘temple’ de la valve mitrale, nous avons réussi à jeter les bases d’une première version de l’outil, avec des tests in-vivo et ex-vivo sur des cœurs de porcs. Depuis mon retour en France, nous avons avancé sur l’amélioration de l’outil qui permet désormais de mesurer les forces de coaptation directement sur un cathéter, pendant des interventions à cœur battant. C’est une vraie avancée pour la chirurgie mini-invasive », se réjouit le médecin.
Aujourd’hui, les nombreux scientifiques engagés dans ces deux projets poursuivent leurs recherches. Grâce à des liens renforcés entre les laboratoires de l’INSA Lyon, les Hospices Civils de Lyon et l’hôpital new yorkais, Daniel Grinberg a bon espoir de voir un appareil apparaître dans les prochaines années. « En tant que médecin, je me dois de garder les pieds sur terre et ne pas vendre de la poudre de perlimpinpin. Il reste encore beaucoup de travail avant de pouvoir fournir aux chirurgiens cardiaques et aux cardiologues, un outil utile, efficace et règlementaire pour rendre les interventions sur les valves mitrales plus sûres. Mais il est certain que les résultats de ces travaux sont déjà prometteurs et inédits dans le domaine de la médecine valvulaire mitrale », conclut-il.
 Le développement du banc d’essai de mesure de la tension exercée sur les cordages artificiels au cours des procédures NeoChord®️ avait bénéficié en 2019 du soutien d'INSAVALOR, via un BQI (bonus qualité innovation). Ce dispositif a été un appui à ce projet innovant en permettant de faire la « preuve du concept » pendant un an.
Le développement du banc d’essai de mesure de la tension exercée sur les cordages artificiels au cours des procédures NeoChord®️ avait bénéficié en 2019 du soutien d'INSAVALOR, via un BQI (bonus qualité innovation). Ce dispositif a été un appui à ce projet innovant en permettant de faire la « preuve du concept » pendant un an.
1 LGEF : Laboratoire de Génie Électrique et Ferroélectricité (INSA Lyon)
2 EP18157633 – INSA Lyon/Université Lyon1/Hospices Civils de Lyon – dépôt via la SATT Pulsalys
3 Centre de recherche en Acquisition et Traitement d’Images pour la Santé (INSA Lyon/Lyon1/UJM)
4 L’Agence Nationale de la Recherche finance la recherche publique et la recherche partenariale en France

