
Sciences & Société
Soutenance de thèse : Julia PUIG
Doppler couleur cardiaque à partir d'un nombre réduit d'échantillons par apprentissage profond
Doctorante : Julia PUIG
Laboratoire INSA : CREATIS - Centre de Recherche en Acquisition et Traitement de l'image pour la Santé
École doctorale : ED160 EEA - Électronique, Électrotechnique, Automatique de Lyon
L'échocardiographie Doppler couleur permet la visualisation du flux sanguin à l'intérieur du cœur. Cependant, la faible cadence d'images du Doppler couleur empêche une évaluation quantitative de la vitesse du sang tout au long du cycle cardiaque, compromettant ainsi une analyse complète de la fonction ventriculaire. La formation d'une image Doppler couleur implique une acquisition ultrasonore composée d'environ huit acquisitions temporelles, suivie d'un filtrage du clutter pour récupérer les informations sanguines, puis d'une estimation de la vitesse Doppler. Une solution à la faible cadence d'images consiste à réduire le nombre d'acquisitions temporelles pour la reconstruction de chaque image. Cependant, les méthodes classiques de traitement Doppler couleur pour le filtrage du clutter et l'estimation de la vitesse Doppler sont sensibles à cette réduction d'informations temporelles. Parallèlement, l'apprentissage profond, et en particulier les réseaux de neurones convolutionnels, montrent des résultats prometteurs pour le post-traitement des données échocardiographiques dans diverses applications. Cette thèse explore l'utilisation de modèles d'apprentissage profond pour le traitement Doppler couleur d'acquisitions avec un nombre réduit d'échantillons temporels. Nous avons adopté une approche d'apprentissage supervisé en simulant des acquisitions Doppler couleur cardiaques basées sur des patients à l'aide d'un pipeline de simulation modélisant à la fois les mouvements des tissus et du sang. Nous avons ensuite exploré l'utilisation de modèles U-Net basés sur l'attention pour le filtrage du clutter, obtenant des résultats surpassant ceux d'un filtre passe-haut classique. Pour l'estimation de la vitesse Doppler à partir des signaux filtrés, nous avons proposé des modèles d'apprentissage profond basés sur U-Net, ainsi que des stratégies d'augmentation de données permettant d'égaler ou de surpasser la méthode de référence par autocorrélation, tout en atténuant efficacement l'aliasing et le bruit. Pour ces deux tâches, nous avons comparé l'utilisation de représentations en valeurs réelles et complexes, et évalué les modèles proposés sur des expériences in silico et in vivo. Globalement, tous les modèles proposés ont montré une bonne capacité de généralisation aux données in vivo malgré un entraînement uniquement sur des séquences in silico. Enfin, la combinaison des deux méthodes a donné des résultats prometteurs sur des acquisitions avec seulement trois échantillons temporels. Ces résultats démontrent l'intérêt des méthodes d'apprentissage profond supervisé pour le traitement Doppler couleur à partir d'un nombre réduit d'acquisitions.
Additional informations
-
Salle de conférence de la BU sciences de la Doua, Domaine de la Doua, 20 Av. Gaston Berger, 69100 Villeurbanne

Sciences & Société
Soutenance de thèse : Marta BEGHELLA BARTOLI
Développement d'une séquence IRM pour une quantification robuste et efficace de la vitesse du sang simultanément dans le cœur et les grands vaisseaux.
Doctorante : Marta BEGHELLA BARTOLI
Laboratoire INSA : CREATIS - Centre de Recherche en Acquisition et Traitement de l'image pour la Santé
École doctorale : ED162 MEGA - Mécanique, Énergétique, Génie Civil, Acoustique
L'IRM en flux 4D (4D Flow MRI) est une technique d'imagerie par contraste de phase qui permet une évaluation complète de la fonction cardiovasculaire en fournissant des mesures volumétriques du flux sanguin tout au long du cycle cardiaque. La phase du signal IRM est proportionnelle à la vitesse et est limitée par le paramètre d'encodage de vitesse (VENC), ce qui restreint la plage de vitesses à -VENC et +VENC. L'IRM en flux 4D permet de capturer des modèles complexes de flux sanguins, incluant des vitesses faibles dans les veines et des vitesses élevées dans les artères. Le choix du bon VENC est crucial : un VENC faible entraîne un aliasing lorsque les vitesses dépassent ±VENC, tandis qu'un VENC élevé introduit du bruit, rendant les mesures de flux lent peu précises. Le VENC optimal équilibre un bon rapport signal sur bruit (VNR) pour des mesures de flux lent précises et une large gamme dynamique pour éviter l'aliasing. Pour étendre la gamme dynamique de la vitesse, des techniques à double ou multiple VENC sont utilisées, en acquérant des données avec différentes valeurs de VENC. Le déballage standard en double-VENC utilise les données VENC_high pour détecter les sauts de phase dans les données VENC_low, ajoutant ou soustrayant des multiples de 2n pour combiner les avantages des deux acquisitions. Cependant, dans les cas pathologiques, cette méthode est limitée par l'aliasing dans les données VENC_high en raison de vitesses imprévues et élevées. Pour résoudre ce problème, nous avons introduit une nouvelle séquence 4D Flow MRI à double-VENC, basée sur la règle des coprimes pour le rapport de VENC, permettant une gamme dynamique de vitesses étendue, accompagnée d'un algorithme de déballage de vitesses efficace en termes de temps, validé in vitro et démontré in vivo chez des patients présentant des pathologies cardiovasculaires. Malgré ces progrès, les séquences à double-VENC sont limitées par des temps d'acquisition longs. L'échantillonnage radial 3D a émergé comme une solution prometteuse, conservant les données de basse fréquence essentielles lors de l'undersampling, et étant plus résistant aux artefacts de mouvement. En utilisant des acquisitions en libre circulation et des techniques d'auto-gating, l'IRM en flux 4D avec échantillonnage radial 3D permet d'extraire les signaux cardiaques et respiratoires directement des données de k-space, éliminant le besoin d'appareils externes comme les ECG. Nous avons également étudié la performance de la séquence double-VENC coprime combinée avec l'échantillonnage radial 3D pour résoudre les limitations de temps d'acquisition des méthodes à double-VENC. Bien que l'IRM en flux 4D offre des mesures détaillées, sa nature chronophage et son coût élevé la rendent moins pratique comparée à l'échocardiographie, notamment le Doppler couleur, qui est abordable, portable et offre une imagerie en temps réel. Cependant, la nature unidimensionnelle du Doppler couleur et sa dépendance à l'angle d'incidence limitent sa capacité à capturer des modèles complexes de flux tridimensionnels. Des techniques comme la cartographie du flux vectoriel intraventriculaire (iVFM) ont été développées pour extraire des champs de vitesses bidimensionnels à partir des données Doppler couleur, fournissant une représentation plus précise de la dynamique du flux sanguin. Bien que l'iVFM ait été validé par des simulations de dynamique des fluides computationnelle (CFD), des défis demeurent lors de la comparaison de ses résultats avec ceux de l'IRM en flux 4D, la norme en matière de mesures de vitesses de flux sanguin in vivo. Un défi majeur est la possibilité de divergences lors de la comparaison des champs de vitesses instantanés dérivés de l'iVFM avec les données moyennées dans le temps de l'IRM en flux 4D. Dans cette thèse, nous avons développé une méthodologie visant à réconcilier ces divergences en comparant les champs de vitesses mesurés par les deux techniques au sein du ventricule gauche.
Additional informations
-
Amphithéâtre de la BU Sciences DOUA, 20 Av. Gaston Berger, 69100, Villeurbanne

Sciences & Société
Soutenance de thèse : Simon TOINET
Développement et caractérisation de matériaux électroactifs conformables pour des applications médicales.
Doctorant : Simon TOINET
Laboratoire INSA : LGEF - Laboratoire de Génie Électrique et Ferroélectricité
École doctorale : ED162 MEGA - Mécanique, Énergétique, Génie Civil, Acoustique
Les maladies cardiovasculaires restent la première cause de mortalité mondiale, et leurs complications représentent un défi majeur pour la santé publique. Depuis une quinzaine d'années, les techniques endovasculaires se sont imposées comme le traitement de référence pour les anévrismes et les maladies artérielles périphériques, grâce à leur capacité à réduire les risques chirurgicaux et les coûts de santé. Cette évolution a été soutenue par une collaboration entre chirurgiens vasculaires et ingénieurs, visant à améliorer la précision opératoire et optimiser les conditions en bloc opératoire, notamment par la conception de guides et sondes orientables. Cependant, aucune solution actuelle ne répond pleinement aux exigences en termes de fiabilité, sécurité et encombrement. Cette thèse a pour objectif de développer un guide de navigation intra-artériel orientable électriquement. Deux polymères électroactifs, à base de polyfluorure de vinylidène (PVDF), ont été étudiés pour leur intégration dans un actionneur positionné à l'extrémité du guide. Une étude expérimentale combinant analyses électriques, mécaniques, structurelles, morphologiques et thermiques, appuyée par des modèles analytiques et éléments finis, a permis d'analyser les paramètres influençant la courbure de l'actionneur. Ces résultats ont conduit à l'élaboration d'une notice de calcul pour la conception optimale des actionneurs multicouches en flexion. L'optimisation du procédé de fabrication a permis de développer des actionneurs orientables à basse tension et faible courant, conformes aux normes de sécurité. Des prototypes de guides d'environ 1 mm, intégrant ces actionneurs optimisés, ont été fabriqués et testés dans un banc artère perfusé par un chirurgien. Les essais ont démontré la faisabilité du concept, atteignant les artères cibles du banc, constituant une preuve de concept solide du guide de navigation artérielle orientable électriquement.
Additional informations
-
Amphithéâtre AEl, Batiment Gustave Ferrié, 8 Rue de la Physique, 69100 Villeurbanne

Sciences & Société
Soutenance de thèse : Hang Jung LING
Écoulement intraventriculaire en échocardiographie Doppler avec réseaux de neurones fondés sur la physique
Doctorant : Hang Jung LING
Laboratoire INSA : CREATIS
École doctorale : ED162 : MEGA de Lyon (Mécanique, Energétique, Génie civil, Acoustique)
Les maladies cardiovasculaires sont les principales causes de décès dans le monde, causant plus de 20 millions de décès chaque année. L'évaluation de la santé cardiaque est cruciale pour prévenir ces maladies. Pour cela, l'échocardiographie est couramment utilisée en routine clinique à cause de sa portabilité et de son coût abordable. Les examens échocardiographiques évaluent la fonction systolique et diastolique du cœur, mais les mesures de la fonction diastolique peuvent parfois donner des résultats de diagnostic discordants. Explorer des biomarqueurs alternatifs, comme le flux sanguin intracardiaque, pourrait améliorer la précision de la quantification de la fonction diastolique. La cartographie du flux vectoriel intraventriculaire ou “intraventricular vector flow mapping” (iVFM) est une technique qui reconstruit le flux sanguin vectoriel à partir des champs scalaires fournis par l'échocardiographie Doppler couleur, mais elle nécessite des étapes de prétraitement chronophages. Dans cette thèse, nous avons utilisé l'apprentissage profond (DL) pour automatiser ces étapes, y compris la segmentation du ventricule gauche et la correction des artefacts de repliement de phase ou l'aliasing. Nous avons également développé des méthodes basées sur les réseaux de neurones fondés sur la physique pour reconstruire l’écoulement vectoriel intraventriculaire, montrant que ces approches peuvent améliorer l'efficacité et la précision de l'iVFM. L'automatisation complète du pipeline d'iVFM à l'aide de réseaux de neurones, de la segmentation à la reconstruction du flux vectoriel, améliore la fiabilité de l'iVFM. La prochaine étape serait d'appliquer cet outil en milieu clinique pour explorer et extraire de nouveaux biomarqueurs basés sur le flux, ce qui pourrait bénéficier à la détection précoce des maladies cardiovasculaires.
Additional informations
-
Salle de conférence de la Bibliothèque Universitaire de Sciences - (BU Lyon1) (Villeurbanne)

Sciences & Société
Soutenance de thèse : Nathan PAINCHAUD
Apprentissage profond de variétés pour une meilleure caractérisation de l'hypertension artérielle en imagerie échocardiographique
Doctorant : Nathan PAINCHAUD
Laboratoire INSA : CREATIS
École doctorale : ED160 : EEA (Electronique, Electrotechnique, Automatique)
L'hypertension artérielle est une maladie cardiovasculaire répandue, affectant plus de 1,2 milliard de personnes dans le monde. Son diagnostic est difficile en raison de la variété des symptômes et du manque d'outils d'analyse rapides et précis. Cette thèse propose une méthode d'apprentissage automatique pour analyser les données médicales, particulièrement les images échocardiographiques, et extraire des informations pertinentes pour le diagnostic de l'hypertension. Les méthodes proposées combinent des modèles d'apprentissage automatique avec des techniques d'apprentissage de représentation pour garantir la cohérence des prédictions et améliorer leur interprétabilité. Des descripteurs de forme et de déformation sont extraits des images segmentées et combinés avec des données des dossiers médicaux électroniques. Un transformeur multimodal est utilisé pour apprendre une représentation commune de ces données, capable de mettre en évidence le continuum pathologique de l'hypertension. L'application de la méthode à une population de patients a permis de détecter des profils subtils de formes et de déformations corrélés avec l'hypertension. Ces résultats ouvrent la voie à de nouvelles études sur les mécanismes pathologiques de l'hypertension et à l'amélioration du diagnostic de la maladie.
Additional informations
-
Bibliothèque universitaire des sciences, Amphithéâtre - Université Lyon 1 (Villeurbanne)

Sciences & Société
Soutenance de thèse : Yuhan JING
Simulation de la diffusion de l'eau dans les tissus biologiques, application au tissu cardiaque
Doctorante : Yuhan JING
Laboratoire INSA : CREATIS
Ecole doctorale : ED205 : EDISS
Cardiovascular diseases remain one of the most serious health problems in the world, motivating research that deepens our understanding of the myocardial function. There are still large shadow areas in the understanding of the relationships between the mechanical function, hemodynamic/perfusion/diffusion/percolation/transfer rate and
the adaptive structural changes emerging in cardiac diseases (Cardiomyopathy, ischemia). To better understand the way the water molecules diffuse within the cardiac tissue, the Ph.D. will build a simulator able to mimic the motion of water molecules through both simple and realistic virtual 3D cardiac tissue models and will couple it to a Virtual
Magnetic Resonance Imaging device able to image the Diffusion (v_DMRI).
.
Additional informations
-
Salle de conférence de la bibliothèque universitaire, Université Lyon 1 - Campus LyonTech - La Doua(Villeurbanne)
Recherche
La mécanique du cœur : quand la valve mitrale déraille
« Boum-boum. Boum-boum ». Il est certainement l’organe le plus symbolique du corps humain : imprimé sur les cartes de Saint-Valentin, dessiné avec les doigts pour dire son amour à sa moitié derrière une vitre ou même, gravé au compas sur une table de classe, la réalité biologique du cœur est pourtant un peu moins tendre. À peine plus grand que la taille d’un poing fermé, il structure une anatomie extrêmement complexe. Parmi les nombreux éléments qui le compose : la valve mitrale qui impose un sens unique à la circulation sanguine et peut se trouver endommagée avec le temps et conduire à une dégradation progressive de la fonction cardiaque.
Daniel Grinberg est chirurgien cardiaque à l’hôpital Louis Pradel de Bron (HCL), et a récemment soutenu une thèse à l’INSA Lyon. En collaboration avec le laboratoires LGEF1, l’hôpital Mount Sinaï à New York, et son équipe hospitalière au CHU de Lyon, il travaille à l’élaboration d’un outil d’aide au chirurgien pour faciliter les chirurgies valvulaires mitrales et les rendre plus efficaces. Immersion au cœur de la machine.
La valve en bandoulière
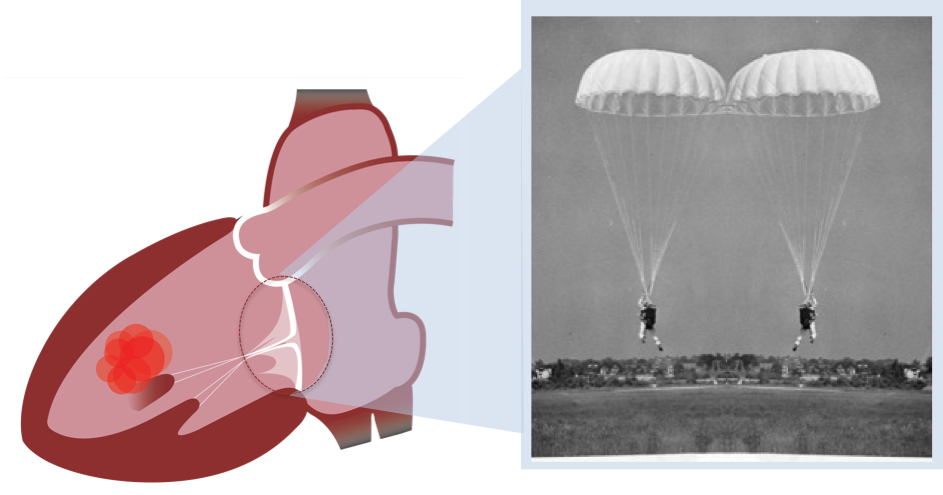
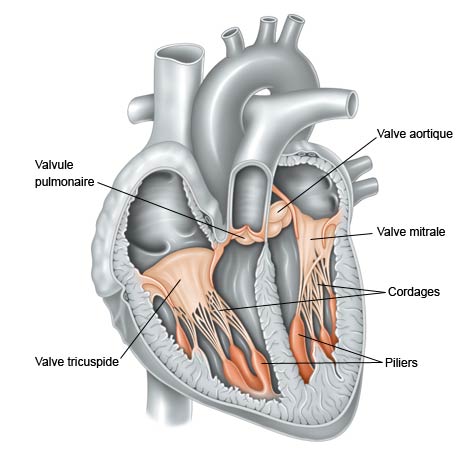
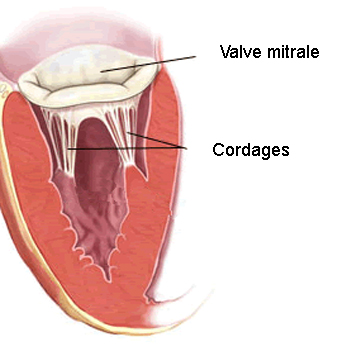
La valve mitrale est l’une des quatre valves séparant les cavités cardiaques qui composent le cœur. Comme un clapet, elle guide le sang, l’empêchant de revenir en arrière. « La valve mitrale se situe entre l’oreillette gauche et le ventricule gauche. Elle ressemble et fonctionne comme un double parachute : quand le cœur se contracte, le sang s’engouffre dans la voilure et les parachutes se gonflent jusqu’à se toucher. C’est ce contact qui forme le clapet antiretour et assure la circulation sanguine et ce, 2 milliards de fois au cours d’une vie humaine ! Dès lors qu’un élément des parachutes est abimé (la voilure, appelée ici « valvule » ou les fils tracteurs, appelés ici « cordages »), la valve mitrale n’assure plus son rôle et le cœur fatigue. Quand la mécanique ne fonctionne plus, il faut opérer, pour au mieux réparer la valve ou bien la remplacer par une prothèse », explique le docteur Grinberg, du service de chirurgie cardiaque adulte à l’hôpital Louis Pradel.
En France, près de 7000 chirurgies valvulaires mitrales sont réalisées chaque année. En cause de la dégénérescence de cet élément : le temps et l’âge. Plusieurs symptômes peuvent être associés à une mauvaise étanchéité de l’orifice mitral. « En matière d’insuffisance mitrale, il existe des traitements pour diminuer les symptômes, mais seule la chirurgie peut résoudre le fond du problème. Cette chirurgie est difficile car nous ne sommes pas en mesure d’évaluer en direct ce qu’il se passe physiquement dans le coeur pendant une opération. Par exemple, lorsque l’on effectue une réparation, on arrête le cœur : il est mou et vide de sang, alors lorsqu’il est remis en route, il se peut que cette réparation ne fonctionne pas aussi bien qu’elle devrait. Il n’existe pas de système à 100% fiable et certains patients reviennent nous voir des semaines, des mois ou des années après l’intervention pour une récidive de fuite. Nous avons donc cherché à développer des outils permettant d’évaluer les changements physiques survenants pendant la chirurgie, qui pourraient nous aider à éviter les récidives », ajoute le docteur.
La rencontre avec le laboratoire LGEF : « It’s a crush ! »
En 2015, lorsque le Dr. Daniel Grinberg et le Pf. Jean-François Obadia viennent frapper à la porte des laboratoires de l’INSA Lyon, ils travaillent déjà à remplacer les cordages rompus par des cordages artificiels en Gore Tex, sans même arrêter le cœur grâce au dispositif NeoChord DS1000®️. « C’est entre deux chirurgies et autour de quelques sandwichs que nous avons fait connaissance avec Pierre-Jean Cottinet, enseignant-chercheur à l’INSA Lyon et au LGEF, qui est par la suite devenu mon ami et mon directeur de thèse. Nous avons amené la première problématique : comment mesurer la tension qui s’exerce sur ces cordages artificiels pendant l’opération ? Cette question n’a été que la première d’une longue série », poursuit Daniel.
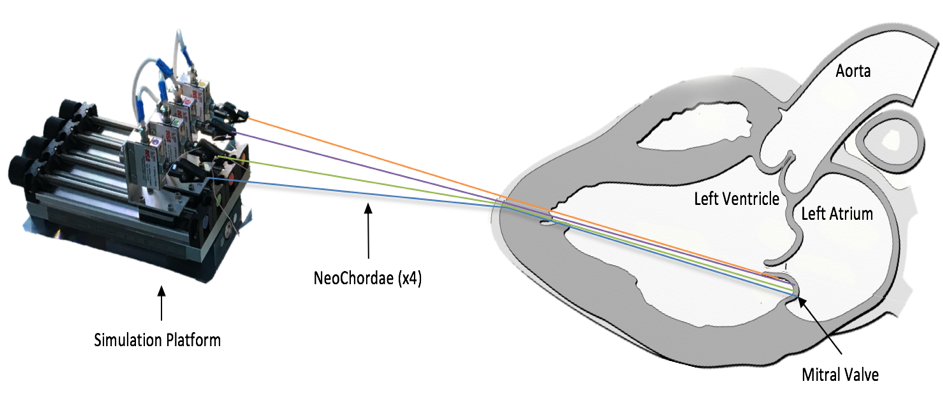
De fil en aiguille, les médecins et les chercheurs de l’INSA Lyon parviennent à développer un banc d’essai : c’est la première fois qu’il est possible de mesurer chez l’homme, à cœur battant et pendant une opération chirurgicale, la tension exercée sur les cordages mitraux. Le banc d’essai développé, désormais breveté2, a fait l’objet de différentes publications scientifiques et salué par les experts du domaine. Mais les chercheurs et médecins ne s’arrêtent pas là. « Les données récoltées par notre banc d’essai étaient totalement inédites et nous ont permis de mieux comprendre les maladies mitrales et les conséquences de la chirurgie. Mais après ces observations faites, il s’agissait de les comprendre. Nous avons débuté une collaboration avec des laboratoires spécialisés en imagerie médicale et en simulation numérique dont le laboratoire CREATIS3, pour créer et optimiser des modèles de « cœur numérique » et ainsi, essayer de comprendre les facteurs influençant la tension des cordages. Nous sommes encore en train de travailler sur le phénomène à travers un projet ANR intitulé ‘SIMR’. »
Le cœur à l’ouvrage
Parmi les autres paramètres capables d’influencer la qualité de l’étanchéité de la valve mitrale, il y a la coaptation, qui correspond à la force de contact entre les deux parachutes composant la valve. « La coaptation est la force que ces deux valvules ont à se fermer l’une contre l’autre et cette force conditionne l’étanchéité de la valve. C’est le sujet du second outil que nous avons développé et breveté pendant mon travail de thèse au LGEF. Nous voulons que cet outil puisse d’une part nous aider à comprendre les maladies et les conséquences de la chirurgie mitrale, et d’autre part, en faire un appareil qui permette d’assister le chirurgien pendant son intervention », poursuit-il.

Dans le cadre de sa thèse, Daniel Grinberg s’est envolé pour New York, à l’hôpital du Mont Sinaï. « Au sein de cet hôpital, que l’on peut considérer comme le ‘temple’ de la valve mitrale, nous avons réussi à jeter les bases d’une première version de l’outil, avec des tests in-vivo et ex-vivo sur des cœurs de porcs. Depuis mon retour en France, nous avons avancé sur l’amélioration de l’outil qui permet désormais de mesurer les forces de coaptation directement sur un cathéter, pendant des interventions à cœur battant. C’est une vraie avancée pour la chirurgie mini-invasive », se réjouit le médecin.
Aujourd’hui, les nombreux scientifiques engagés dans ces deux projets poursuivent leurs recherches. Grâce à des liens renforcés entre les laboratoires de l’INSA Lyon, les Hospices Civils de Lyon et l’hôpital new yorkais, Daniel Grinberg a bon espoir de voir un appareil apparaître dans les prochaines années. « En tant que médecin, je me dois de garder les pieds sur terre et ne pas vendre de la poudre de perlimpinpin. Il reste encore beaucoup de travail avant de pouvoir fournir aux chirurgiens cardiaques et aux cardiologues, un outil utile, efficace et règlementaire pour rendre les interventions sur les valves mitrales plus sûres. Mais il est certain que les résultats de ces travaux sont déjà prometteurs et inédits dans le domaine de la médecine valvulaire mitrale », conclut-il.
 Le développement du banc d’essai de mesure de la tension exercée sur les cordages artificiels au cours des procédures NeoChord®️ avait bénéficié en 2019 du soutien d'INSAVALOR, via un BQI (bonus qualité innovation). Ce dispositif a été un appui à ce projet innovant en permettant de faire la « preuve du concept » pendant un an.
Le développement du banc d’essai de mesure de la tension exercée sur les cordages artificiels au cours des procédures NeoChord®️ avait bénéficié en 2019 du soutien d'INSAVALOR, via un BQI (bonus qualité innovation). Ce dispositif a été un appui à ce projet innovant en permettant de faire la « preuve du concept » pendant un an.
1 LGEF : Laboratoire de Génie Électrique et Ferroélectricité (INSA Lyon)
2 EP18157633 – INSA Lyon/Université Lyon1/Hospices Civils de Lyon – dépôt via la SATT Pulsalys
3 Centre de recherche en Acquisition et Traitement d’Images pour la Santé (INSA Lyon/Lyon1/UJM)
4 L’Agence Nationale de la Recherche finance la recherche publique et la recherche partenariale en France

